꿈의 암 치료법이라 불리는 ‘중입자 치료’ 효과를 높일 수 있는 연구결과가 나왔다.
기초과학연구원(IBS) 유전체 항상성 연구단(단장 명경재) 케이이치 타카타 연구위원(Kei-ichi Takata, UNIST 생명과학과 교수) 연구팀은 UNIST 김하진 교수 연구팀과 공동으로, ‘POLQ(DNA Polymerase theta) 단백질’이 암세포가 중입자 치료에 내성을 가지게 하는 원인물질임을 밝혔다. 이 단백질이 중입자 치료로 인한 암세포 DNA의 복합적 이중가닥 절단(Double-strand break, DSB) 손상을 복구하기 때문이다. 이는 세계 최초의 중입자 치료기인 일본 QST병원(국립방사선종합연구소)의 HIMAC(Heavy Ion Medical Accelerator in Chiba)을 활용해 암세포의 특성을 관찰한 결과로, 향후 항암제 개발 등 중입자 치료의 효과를 높이는 데 기여할 것으로 기대된다.
암 방사선 치료는 암세포에 높은 에너지의 방사선을 조사하여 DNA의 손상을 일으키고 증식을 억제하는 치료 방법이다. 그 중 중입자 치료는 중입자가속기로 빛의 70% 속도로 가속한 탄소이온을 암세포에 정밀하게 조사하여 파괴하는 방법이다. 기존 X선이나 감마선 치료법에 비해 치료효과가 높고 부작용이 적어 차세대 암 치료법으로 평가된다. 중입자 치료기는 전 세계에 단 10여 개국만 보유하고 있으며, 국내에는 올 상반기에 처음 도입될 예정이다.
암 방사선 치료 시 암세포에서 DNA 이중가닥이 절단되며 세포가 파괴된다. 그러나 곧 세포 내 DNA 회복에 관련된 단백질들이 손상을 인식하고, 이중가닥 중 한 가닥을 절개하여 단일가닥을 노출시킨다. 이후 POLQ 단백질이 양쪽 단일가닥 돌출부에 위치한 짧은 상동서열(microhomology)을 접합시키고, 나머지 DNA 한 가닥을 주형으로 새롭게 합성하여 이중가닥 구조를 되찾는다.
중입자 치료는 암세포 내에서 DNA 이중가닥 절단을 비롯해 손상된 염기의 탈락, 타이민 글리콜(Thymine Glycol) 생성 등 산화적 손상을 동반한 ‘복합적’ 이중가닥 절단을 유도하는 것으로 알려져 있다. 기존 연구에 따르면 X선, 감마선 등이 생성하는 단순한 이중가닥 절단과 달리, 복합적 이중가닥 절단은 기존에 알려진 DNA 회복 메커니즘들이 효과적으로 작동하지 못해 암세포가 다른 종류의 DNA 손상에 비해 복구하기 어렵다. 이것이 기존의 방사선 치료보다 중입자 치료가 높은 치료효과를 보이는 주요 원인이다. 그러나 암세포가 중입자 치료에 의해 생성된 복합적 이중가닥 절단을 복구하고, 치료에 내성을 갖는 기전은 아직까지 명확히 밝혀지지 않았다.
* 타이민 글리콜(Thymine Glycol) : 산화 또는 이온화 방사선 조사로 인해 DNA 구성 염기 중 타이민(티민)이 손상된 것으로 DNA 합성 시 인접한 주형가닥 염기와의 결합이 제대로 이루어지지 못한다.
연구진은 DNA 이중가닥 절단을 수선하는 복구 메커니즘에 핵심인 POLQ 단백질이 염기 탈락 부위와 산화적 손상 부위를 우회하여 합성할 수 있는 독특한 DNA 중합효소라는 점을 주목했다. 그리고 유전자 가위 기술을 이용해 POLQ 단백질의 발현을 억제한 암세포에 탄소이온 고선량 방사선을 조사하여 암세포의 반응과 특성을 관찰했다. 그 결과, POLQ 단백질이 발현되지 않은 암세포의 방사선에 대한 생존율이 감소하고, 염색체 불안정성이 크게 증가한 것을 확인했다.
나아가 연구진은 DNA 복합적 이중가닥 절단을 모사한 DNA 분자에 미세 상동 매개 말단 접합 기술과 단분자 형광 공명에너지 전달(Fluorescence Resonance Energy Transfer 기술을 적용하여 POLQ 단백질이 복합적 이중가닥 절단을 복구하는 과정을 재현했다. 그리고 POLQ 단백질이 상보적 염기서열을 가진 두 개의 DNA 가닥을 염기쌍이 되도록 유도시키고, 이 염기쌍으로부터 뉴클레오타이드를 합성하는 것을 확인했다.
* 미세 상동 매개 말단 접합 기술: 상보적 염기서열을 가진 두 가닥의 DNA중 한 가닥에 방사성 동위원소를 부착하여 POLQ가 미세 상동 염기서열을 매개로 접합하는 정도를 확인할 수 있다.
* 단분자 형광 공명에너지 전달(Fluorescence Resonance Energy Transfer) : 각 생분자의 형광 신호를 형광 공명에너지 전달 형태로 측정함으로써, 각 분자의 형태를 실시간으로 관측할 수 있다.
이 실험으로, POLQ 단백질이 암세포의 DNA 복합적 이중가닥 절단을 효율적으로 복구해 중입자 치료의 효과를 줄이고 치료에 내성을 가지게 하는 원인물질임을 증명했다. 이는 암세포의 중입자 치료 내성에 대한 새로운 발견으로, POLQ 단백질의 억제가 중입자 치료의 효과를 높일 가능성을 시사한다.
케이이치 타카타 연구위원은 “이번 연구로 암세포가 중입자 방사선 치료에 대해 내성을 가지게 되는 원인물질을 밝혔다”며, “향후 원인물질을 억제하는 항암제의 개발로 더 높은 치료효과를 기대한다”고 전했다. 또한, “중입자 치료기가 국내에 도입되는 과정에서, 치료효과 향상을 위한 한․일 공동연구가 활발히 진행되길 희망한다”고 밝혔다.
연구성과는 국제학술지 뉴클레익 애시드 리서치(Nucleic Acids Research, IF 19.160)에 2월 20일 온라인 게재됐다.
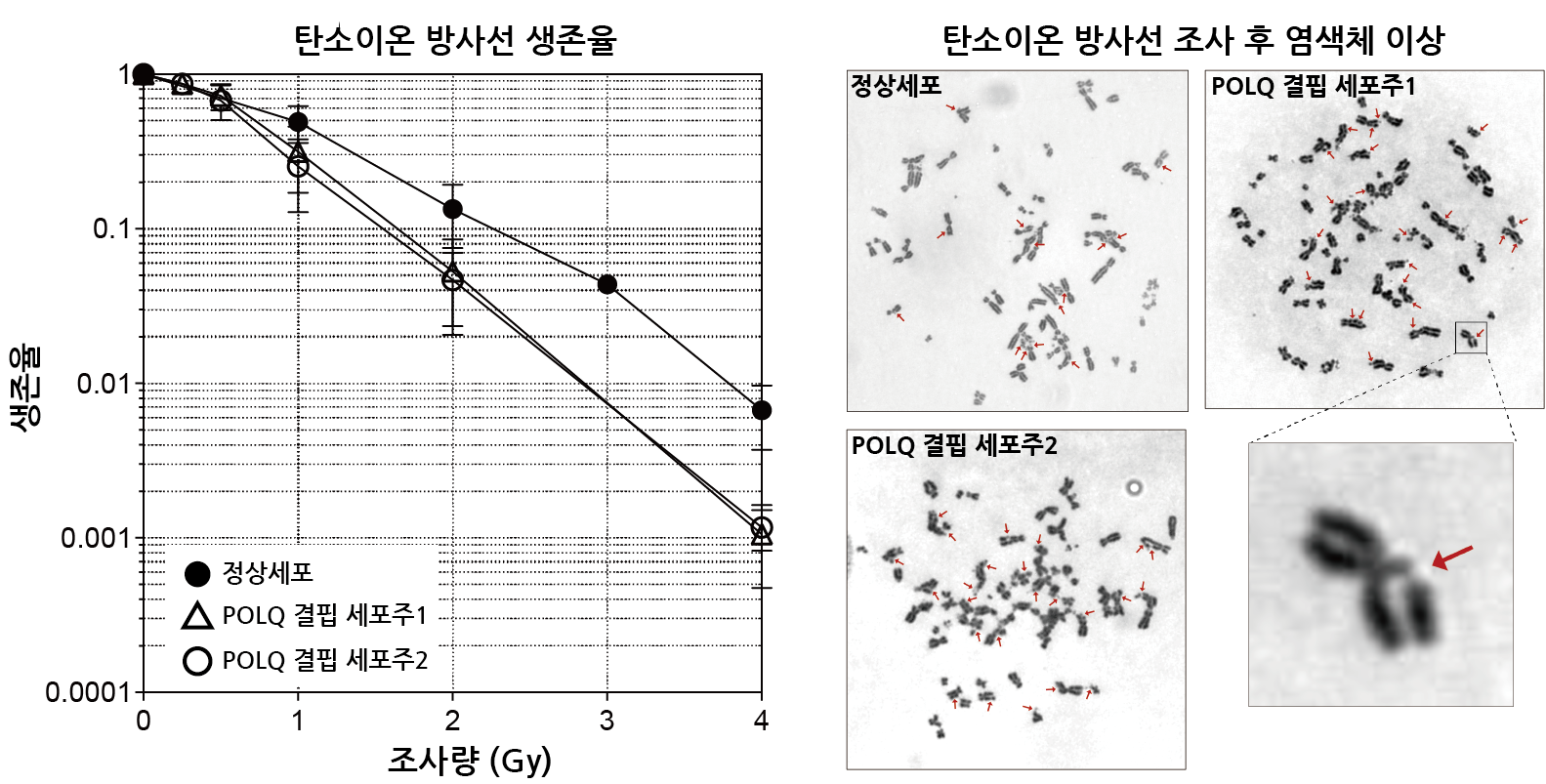
(왼쪽) 정상세포와 POLQ 단백질이 결핍된 세포주에 중입자 방사선인 탄소이온 방사선을 조사한 후 생존율을 비교했다. POLQ 단백질이 결핍된 경우 정상세포에 비해 생존율이 현저히 떨어짐을 관찰했다. (오른쪽) POLQ 단백질이 결핍된 세포주에서 더 많은 수의 염색체 이상을 관찰했다. 빨간색 화살표는 염색체 이상 중 하나인 염색분체의 절단을 가리킨다.

중입자 방사선은 DNA 분자에 강한 이온화를 발생시켜 이중가닥 절단과 산화적 손상이 국소적으로 함께 일어나는 DNA 복합적 이중가닥 절단을 생성한다. 이번 연구에서 이러한 형태의 손상이 POLQ 단백질에 의해 복구이 되고 암세포의 치료 내성을 높인다는 것을 밝혔다.
출처 : 기초과학연구원
'의학' 카테고리의 다른 글
| 뇌에 빔 프로젝터 쏴 뇌 연결지도 만드는 기술 개발 (0) | 2023.04.03 |
|---|---|
| 비강 내 혈관과 림프관 구조 3차원 정밀지도 완성 (0) | 2023.03.25 |
| 다이서 작동 원리 알아내고 활성 상태 다이서 구조 첫 규명 (0) | 2023.02.25 |
| 약물 대사하는 효소 농도가 증가하면 기존 美FDA의 수식은 부정확 (0) | 2023.01.08 |
| 여성 암 환자의 경우, 오후에 받는 항암치료 더 효과적 가능성 제시 (0) | 2022.12.18 |









